2020年7月24日美国食品和药物管理局批准了Tecartus(brexucabtagene autoleucel), 这是一种基于细胞的基因疗法,用于治疗诊断为套细胞淋巴瘤(MCL)的成年患者,这些患者对其他疗法无反应或已复发。 Tecartus是一种嵌合抗原受体(CAR)T细胞疗法,是FDA批准的首个基于细胞的基因疗法,用于治疗MCL。
FDA主任Peter Marks博士说,“在发现使人们难以治疗的疾病变得虚弱的新疗法方面,已经取得了巨大进展。 这项批准是定制疗法的又一个例子,该疗法利用患者自身的免疫系统帮助对抗癌症,我们看到了基因治疗领域的持续进步,并将继续致力于支持这一有前途的新医学领域的创新。”
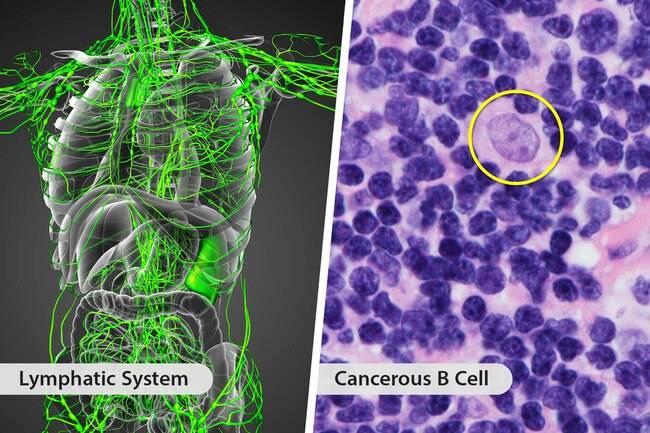
MCL是一种罕见的癌性B细胞非霍奇金淋巴瘤,通常发生于中年或老年人。在患有MCL的患者中,B细胞是一种白细胞,一种可以帮助人体抵抗感染的白细胞,会转变成癌细胞,这些癌细胞开始在淋巴结中形成肿瘤,并迅速扩散到身体的其他部位。
每种Tecartus剂量都是使用患者自己的免疫系统帮助对抗淋巴瘤的定制治疗方。收集患者的T细胞(一种白细胞),并对其进行基因修饰,使其包含有助于靶向和杀死淋巴瘤细胞的新基因。然后将这些修饰的T细胞重新注入患者体内。Tecartus的安全性和有效性是在一项多中心临床试验中建立的,该试验对60例患有难治性或复发性MCL的成年人进行了首次客观疾病反应后,至少随访了六个月。Tecartus治疗后的完全缓解率为62%,客观缓解率为87%。
Tecartus最常见的副作用包括严重感染,血细胞计数低和免疫系统减弱。治疗后的副作用通常会在治疗后的前一到两周内出现,但某些副作用可能会在以后发生。
由于存在CRS和神经毒性的风险,正在批准Tecartus进行风险评估和缓解策略(REMS),其中包括确保安全使用的要素(ETASU)。 Tecartus的风险缓解措施与当前的REMS计划针对另一种CAR-T疗法Yescarta的缓解措施相同。

(原创)美国希望之光医疗编译,欢迎转载,请注明出处。
全球顶级医生协会(Global Top Doctors Association)是美国加州政府正式注册的联邦政府批准的一个非营利性,非宗教,非政治性国际社会组织,总部位于洛杉矶。全球顶级医生协会为中西方医学和精神专业人士的科学研究创造更有利的环境,为他们提供机会在社区,全国以及全球服务人群,满足民众的身体与精神健康需求。

